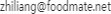一、清潔工藝
附錄是這么說:為確認與產品直接接觸設備的清潔操作規程的有效性,應當進行清潔驗證。其實和工藝驗證是針對生產工藝一樣,清潔驗證針對的也是設備的清潔工藝。
然后就有個問題,我們的清潔工藝怎么做?針對這個問題,就有下面這張圖。
1.1 清潔方式和清潔方法
清潔,其實是對生產中使用的設備進行清潔,而設備的情況決定了設備的清潔方式和清潔方法。
1.1.1 設備清洗位置
在GMP中有這么依據話:如需拆裝設備,還應當規定設備拆裝的順序和方法。所以在拿到設備的時候,我們就應該對設備稍微進行一下分析,設備是否可能進行拆卸,或者拆卸的難以程度。如果方便拆卸和安裝,就可以將可拆卸后,在清洗間進行拆卸(異位)清洗;不易或不能拆卸的使用在位清洗;或者易于拆卸的部分拆卸使用異位清洗,不易拆卸或不能拆卸的部分進行在位清洗的混合清洗。就想我們的一臺粉碎機,每次清洗,都要把里面的腔體內的各種東西卸下來才行。同樣的,哪些不能進行拆卸或者移動的部分,就只能進行在位清潔了。
在確定確定設備是拆卸或者在位清洗以后,在結合人工清洗還是自動清洗,我們可以知道我們的設備清洗的方式:自動化(人工)在位(在線)清洗或人工(自動化)拆卸清洗。
1.1.2 設備清洗形式
在生產線設計之初,公司已經根據自己的情況,來對設備是由人工進行清洗,還是使用在線的自動清洗。當設備清洗使用CIP的時候,采用自動清洗;如果沒有CIP就只能使用人工清洗了;當某些特殊的清洗CIP不能完全滿足時候,就需要使用人工進行一些輔助,這個時候就是自動和人工同時存在的混合清洗形式了。這些需要在設備設計的時候就要進行考慮的。就像我們設備經理談到了:我現在是人工清洗,但是我要為以后的自動清潔留下可能,當然了,至于這些可能如何達到,就是需要他進行考慮的了。
1.1.3 設備清洗方法
當知道了設備的在哪里清洗,使用人工還是自動清洗以后,根據它們之間的組合,就會產生針對設備及部件的清洗方法:浸泡清洗、擦拭清潔、淋洗或者其它合適的清洗方法。
1.1.4 清洗方式
設備及部件的可拆卸和安裝的便利行,決定了設備是拆卸清洗、在位清洗或兩個同時存在;設備清洗的自動化程度,決定了是使用自動清洗、人工清洗或混合清洗;結合上面兩點,可以知道設備及部件采用浸泡清洗、擦拭清潔、淋洗或者其它合適的清洗方法;將這三個方面就會知道設備的清洗方式了。
1.2 清潔劑
在知道了設備的清洗方式以后,我們還需要知道:設備清洗要去除的哪些東西,使用什么樣的清洗劑進行去除。而這些就是使用設備生產的產品所決定的了。
需要去除的是物質(活性成分、指標性成分、……)的物理或化學的性質決定了它們的溶解性、附著能力(決定被去除的難易程度)等性質,這些就決定了,在設備清洗過程為去除殘留物使用的清潔劑,如水。
1.3 清潔工藝
確定了設備清潔方式、設備清潔方法及使用的清潔劑后,在結合清潔劑的性質(PH值、溫度……)和清潔的參數(清潔劑流速、流量、壓力……),就形成了一個完整的設備清潔工藝。
二、清潔驗證
清潔工藝確定以后,我們需要對清潔工藝進行驗證。在清潔驗證中涉及到了:取樣方法、取樣部位(點)、殘留限度以及取樣回收率等內容。
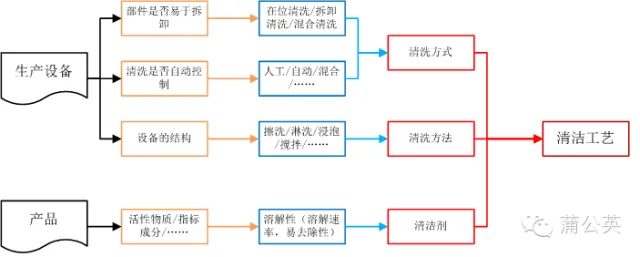
2.1 清洗驗證取樣方法和取樣部位(點)的確定
其實取樣部位和取樣方法基本上是由設備來決定的
2.1.1 清洗驗證取樣部位(點)
設備及部件的易拆卸程度和清洗的自動化程度決定了設備清洗方式的同時亦決定了取樣部位。例如:各種難以清洗到的部位以及自動清洗的排放口等位置。
2.1.2 清洗驗證取樣方法
設備的結構在決定了清洗方法(浸泡、淋洗、擦拭、……)的同時亦決定了取樣方法,如最終淋洗液取樣或擦拭取樣。
2.1.3 設備與取樣部位和取樣方法的關系圖
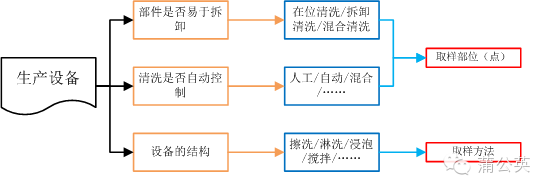
2.2 殘留限度
殘留限度是由產品的殘留量和共用的生產設備共同決定的
2.2.1 殘留量
在殘留量確定過程中,驗證與確認附錄要求考慮兩個東西:產品的毒性和日允許接觸劑量。后一個大家都很清楚,不同的就是前者-產品毒性,現在普遍的說法這個是指藥理實驗的半數致死量。
同樣,多產品共線的清潔驗證,在代表性產品的選擇上,也需要將產品毒性考慮進去了。在開展的培訓中,也給出了使用毒性來計算殘留量的公式,大家有興趣的話,可以去找找。同時藥理學也告訴我們,藥品的半數致死劑量是遠遠大于日服用劑量的,所以一般情況下使用毒性數據得到的殘留量遠遠大于使用日允許接觸劑量數據得到的殘留量,當然特殊情況除外。
現在流行的殘留量計算方式就是:10ppm和上一產品在下一產品日最大服用劑量中的殘留量不能超過自身日最小服用劑量的千分之一。現在的話,再加一個使用半數致死量計算的殘留量,比較一下選擇一個合適殘留限度。
2.2.2 共用面積
在附錄的清潔驗證部分,有這么一句話:可接受標準應當考慮工藝設備鏈中多個設備潛在的累積效應。其實這句話也就是說產品在整條生產線上的殘留總和也就是10ppm或者千分之一,而不是以前在每臺設備上的殘留都是10ppm或者千分之一。這么一來,只要知道了整個產品生產線上共用的設備,就知道了與藥品直接接觸的設備總面積。
2.2.3 殘留限度
知道了產品允許的殘留量,也知道了與藥品直接接觸的設備總面積,除一下就能知道在單位面積上的殘留限度。
所以在對產品的共線情況進行分析以后,我們的清潔驗證方案就可以進行合并了,反正共用的設備殘留限度一樣,那么在驗證方案的前半段就是進行產品的選擇、殘留量、共用面積以及殘留量的計算,弄些表格,洋氣的說法就是弄些矩陣來進行說明。
2.2.4 下面這張圖,是殘留限度確定的一個關系圖
2.3 取樣回收率試驗
通過2.1知道了,清洗驗證取樣方法和取樣部位(點),通過2.2知道了殘留物的殘留限度,按照清潔驗證的流程,這個時候是QC按照方法去進行取樣和檢驗了。既然是取樣,那就要保證取樣方法的有效性了,怎么保證:驗證,通過取樣回收率試驗來證明取樣方法的可行性
2.3.1 怎么做回收率試驗
既然這里說的是回收率試驗,那肯定不是直接在生產設備上來進行了, 這個時候就需要殘留物的標準溶液涂布在于設備相同材質的板材或管道中,干燥,備用。
使用規定的取樣工具和取樣溶劑,按照取樣要求的方法進行擦拭或者淋洗取樣。樣品按照要求進行處理以后,使用適合的檢測工具對進行檢測,計算出回收率。
2.3.2 取樣回收率大概的關系圖
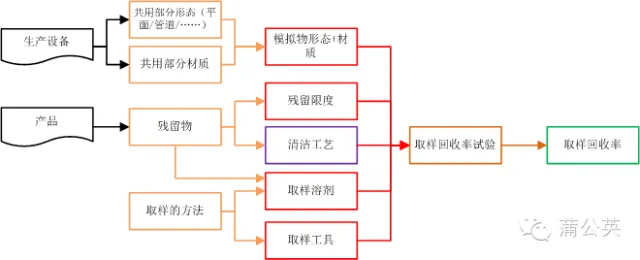
2.3.3 可能會出現的問題
使用經過驗證或確認的標準進行質量檢驗,已經是一個共識了,那在清潔驗證里面就有了問題。
2.3.3.1 有殘留限度要求,進行了取樣,就會有殘留物的檢測限度問題,這是時候是不是對檢驗設備的靈敏度進行確認?應該是需要的
2.3.3.2 有了檢測設備,也就有了檢驗方法,那是不是需要對殘留物的檢驗方法進行確認或驗證?也許需要吧。
2.3.3.3 也許就有了下面這個圖

似乎整個回收率試驗就是一個對殘留物檢驗方法的一個確認或者驗證的過程。
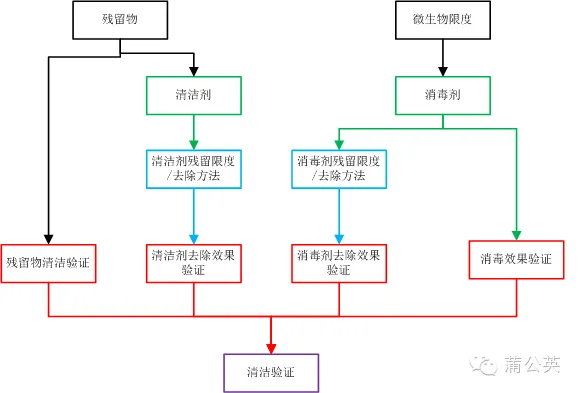
2.4 清潔劑殘留和微生物限度
附錄說了:應當根據所涉及的物料,合理地確定活性物質殘留、清潔劑和微生物污染的限度標準。
2.4.1 清潔劑殘留
附錄還說了:如使用清潔劑,其去除方法及殘留量應該進行確認。當使用的清潔劑會出來殘留的時候,我們需要通過對清潔劑的殘留量確認來證明其去除方法的有效性。這就要求,使用清潔的產品成分清晰,明確。在清潔劑成分不明的情況下殘留量的確認比活性成分清潔驗證難度大的多。
2.4.2 微生物限度
其實微生物限度,并不能真的算到清潔驗證里面來,要混到一起的話也沒有問題,畢竟清洗過程本身就是一個微生物的去除過程。當然,就個人而言更喜歡將微生物限度,作為一個清洗后消毒劑消毒效果的確認。
和清潔劑的要求一樣,當使用的消毒劑會產生殘留時,也需要對消毒劑的殘留進行去除和確認。所以為了減少麻煩,設備消毒使用的消毒劑最好選擇沒有殘留的,比如75%酒精。
2.5 清潔驗證
將殘留物的清潔驗證、清潔劑的去除效果驗證、消毒效果驗證及消毒劑殘留確認組合起來,可以看成是一個完整的清潔驗證方案,當然了,不是要大家把這些都寫到一個方案里面,而是根據實際的情況對這些驗證進行拆分。
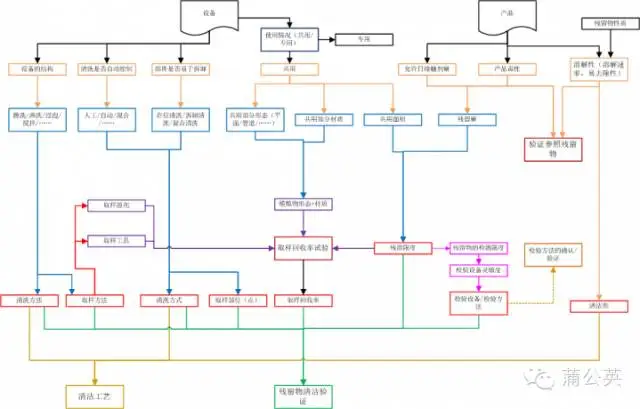
三、從清潔工藝到驗證
上面寫了很多,圖也畫了不少,最后將這圖進行了拼裝,就形成里面這張總圖。在這張總圖里面有添加了一些,前面沒有說的東西,有興趣的話,可以仔細看看
四、總結
4.1 上述內容是根據當時培訓的需要做的一些東西,算是個人對清潔工藝和清潔驗證理解的總結和梳理,因為經驗和知識水平方面的問題,肯定還有很多的不足,所以各位看官看過以后,需要將各位的意見寫一下。
4.2本文還有一個不足的部分就是沒有針對附錄中清潔驗證部分的條款進行更多的說明。其實附錄里面的清潔驗證和10版GMP執行以后大家所做的清潔驗證內容沒有太大的區別,如果說有的話,也就是要考慮產品毒性了。
4.3 對于專線生產的產品是不是需要進行清潔驗證,其實已經有了很多討論,在清潔驗證部分最后一條是這么寫的:如無法采用清潔驗證的方式來評價設備清潔效果,則產品應當采用專用設備生產。這句話反過來理解的話,就是使用專線生產的時候,可以不采用清潔驗證的方式來評價設備的清潔效果。當然了,這個時候肯定要考慮其它的問題了。
4.4 其實清潔驗證部分不僅僅是要求我們進行清潔驗證。里面的一些內容其實是對我們現在清場中的大清和小清進行了相應的要求,如:當采用階段性生產組織方式時,應當綜合考慮階段性生產的最長時間和最大批次數量,以作為清潔驗證的評價依據。
4.5 其實很多的以前沒有明確的東西,在確認與驗證附錄里面都進行了說明,大家有時間的話可以去多閱讀幾次條款。這個真的很有必要。  手機版
手機版